
Al fin y al cabo, ¿qué es y para qué sirve el pH?
Uno de los parámetros más importantes que hay que mantener bajo control (o al menos bajo observación) cuando se trabaja con productos químicos es el pH. Por lo tanto, si usted trabaja en una industria de este sector, seguramente se habrá encontrado con estas dos letras en algún momento. Pero, en la práctica, ¿qué significa esta sigla y cómo puede afectar a sus productos?
.jpg)
Definición de pH
Comencemos a explorar este término y veamos a dónde nos lleva este tema. En general, podemos empezar con la definición de qué es el pH. Si le preguntas esto a un químico, es probable que recibas una respuesta como "el pH es el potencial de hidrógeno de una solución" o "el pH es una escala matemática utilizada para medir la acidez o basicidad de una solución".
Tenga en cuenta que ninguna de las definiciones anteriores es realmente incorrecta. Pero observe que tampoco dicen mucho a las personas que no tienen un conocimiento más profundo de la química. Después de todo, ¿qué significan términos como potencial de hidrógeno, acidez o basicidad? De los tres términos mencionados, los dos últimos pueden parecer un poco más fáciles de entender, pero ¿los términos acidez y basicidad por sí solos dicen algo real?
De manera directa, estos dos términos no dicen nada muy concluyente, es decir, los consideraremos tan vagos como el potencial de hidrógeno. Sin embargo, podemos partir de ellos para intentar comprender qué es el pH de una forma más asimilable y, para ello, inicialmente, vamos a recurrir a uno de nuestros sentidos, el gusto.
Estos dos términos se asocian fácilmente con dos tipos de sabores. La acidez puede relacionarse con el sabor agrio, es decir, los alimentos ricos en sabor agrio son los llamados alimentos ácidos. Por ejemplo, el limón y otras frutas cítricas son alimentos que encajan en este grupo, ya que son ricos en ácido cítrico. Por otro lado, la basicidad, o alcalinidad, está directamente relacionada con aquellos alimentos que dejan una sensación de boca seca, áspera o arrugada, como los vinos secos y las frutas que aún no están debidamente maduras, es decir, con el sabor astringente.
Ahora que empezamos con esta distinción entre acidez y basicidad, podemos introducir el concepto de pH: si sabemos que existen estos dos tipos de sabor, ¿no sería posible establecer alguna forma de medir lo ácido o lo astringente que es un alimento? Por ejemplo, si comparamos el sabor de un limón con el de la lechuga, sabemos que el limón tiene un sabor mucho más ácido que la lechuga, que tiene un sabor astringente, pero ¿cuánto más ácido es este sabor?
Podemos entonces introducir el pH como una forma de medir lo ácido o lo básico que es un alimento. Por lo tanto, si identificamos algo que sea medible para cuantificar la acidez, podemos establecer una escala. Sin embargo, para saber qué se va a medir, no podemos eludir los conceptos químicos y físicos.
Retrocediendo en el tiempo...
A finales del siglo XIX, el científico sueco Svante Arrhenius, uno de los fundadores de la ciencia que hoy se conoce como físico-química, desarrolló la teoría de la autoionización del agua mientras estudiaba una forma de explicar la conductividad de los electrolitos. En sus estudios, Arrhenius propuso que las moléculas de agua en estado líquido no se comportan de forma estática, sino en un equilibrio dinámico, en el que se rompen y se reconstituyen. En términos químicos, Arrhenius propuso que la molécula de agua, HO en estado líquido, se comporta de la siguiente manera:
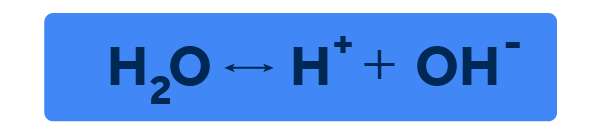
Así, según la propuesta de Arrhenius, las moléculas de agua no solo sufren interacciones de sus fuerzas internas, formando y rompiendo enlaces de hidrógeno, sino que también se encuentran en esta danza dinámica, donde la molécula se rompe, generando iones de carga positiva y negativa, y se reconstituye, volviendo al estado neutro de una molécula.
Partiendo de esta teoría, Arrhenius propuso la primera teoría de ácidos y bases en 1887, en la que proponía que un ácido sería una sustancia que, al solubilizarse en agua, se ioniza y produce un catión H, llamado hidrógeno, que tiene una carga positiva. Por su parte, una base sería una sustancia
que, al disolverse en agua, se ioniza y produce un anión OH, llamado hidroxilo, que tiene una carga negativa.
Aunque sencilla, esta teoría propuesta por Arrhenius era un poco restrictiva. Así que, en 1923, los científicos Johannes Brønsted y Martin Lowry perfeccionaron las teorías propuestas por Arrhenius, redefiniendo los ácidos como aquellas sustancias capaces de donar iones H+ y las bases como aquellas sustancias capaces de recibir iones H+. Más tarde, Lewys propuso una nueva definición de ácidos y bases que se volvió más amplia y compleja, definiendo los ácidos y las bases como compuestos capaces de donar o recibir pares de electrones. Esta nueva y más amplia definición de Lewys nos permite incluir el amoníaco, NH, y sus derivados orgánicos (como las aminas) como bases, ya que, a pesar de no recibir H+ en solución acuosa, como propusieron Johannes Brønsted y Martin Lowry, son sustancias que tienen la capacidad de donar pares de electrones.
La escala de pH
Partiendo de estas definiciones de ácidos y bases, podemos inferir que un medio ácido será un medio deficitario en electrones y un medio básico (o alcalino) será un medio rico en electrones libres. Es decir, hemos visto que podemos evaluar la acidez o basicidad de un medio determinado a partir de ciertas características electrónicas del mismo, y aquí es donde entra en juego la famosa escala de pH.
El pH no es más que una escala numérica que se construyó a partir de cálculos basados en mediciones de la corriente eléctrica de soluciones acuosas conocidas. Se utilizó la corriente eléctrica, que es precisamente el movimiento de los electrones, ya que era la que permitía indicar la "disponibilidad" de pares de electrones libres en esas soluciones. A partir de estas mediciones fue posible identificar la basicidad o acidez de una solución. Esta escala fue desarrollada por primera vez en 1909 en Dinamarca por el químico Søren Lauritz Sørensen en la fábrica de cerveza Carlsberg, y se perfeccionó tras la divulgación de las teorías de Brønsted y Lowry.

En general, es muy común escuchar que la escala de pH varía de 1 a 14, y que cuanto más ácido es un medio, menor será el pH, y cuanto más alcalino, mayor será el pH. Aunque en la mayoría de los casos el pH se encuentra realmente entre estos valores, algunos ácidos y bases muy fuertes pueden hacer que el pH sea inferior a 1 o superior a 14, pero se trata de casos muy específicos.
Siguiendo la lógica de los valores de esta escala de pH, podemos incluso pensar en ella como una especie de balanza: si los valores más cercanos a 1 son ácidos y los valores cercanos a 14 son básicos, ¿qué podemos decir de la región en medio de estos valores, es decir, del valor de pH igual a 7? Este es el valor de neutralidad de una solución, es decir, es un valor de la escala en el que no podemos decir que la solución sea ni ácida ni básica.

pH y la industria de los productos de limpieza
Ahora que hemos definido el pH, los ácidos y las bases, ¿qué podemos decir sobre este tema en lo que respecta a los productos de limpieza? Después de todo, por lo que hemos visto, cualquier mezcla que contenga agua puede tener un valor de pH, y el agua es el vehículo más común en las industrias químicas en general.
El pH, sobre todo, es una propiedad fundamental muy importante para diversas clases de productos de limpieza. Intentando explicarlo de forma muy sencilla, el pH ácido reaccionará con la suciedad o las superficies de carácter básico, generalmente constituidas por minerales.
Por otro lado, el pH básico tenderá a reaccionar con la suciedad o las superficies de carácter ácido, como las grasas y los aceites. Esto marca una gran diferencia, ya que si se utiliza, por ejemplo, un pH ácido para limpiar aceites y grasas, se perjudicará el rendimiento del producto, ya que este no reaccionará con este tipo de suciedad. Los productos que se utilizan para una remoción intensiva de aceites y grasas tienden a beneficiarse de un pH más básico/alcalino, ya que esta condición favorece la saponificación de aceites y grasas, que es precisamente la reacción del componente alcalino de la formulación con la grasa formando jabón. Dado que el jabón es soluble en agua, la suciedad puede eliminarse mediante enjuague.
A continuación, podemos ver una tabla con indicaciones y ejemplos de tipos de superficies y suciedad más o menos adecuadas para cada pH. Este conocimiento es fundamental al iniciar el desarrollo de un nuevo producto.
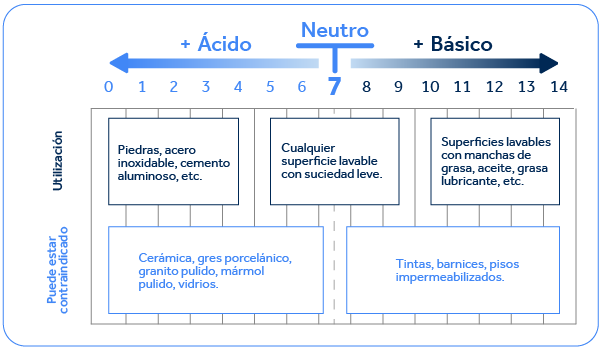
Además de esta preferencia por algunos tipos específicos de limpieza, hay algunas sustancias que necesitan determinados rangos de pH para estabilizarse. Por ejemplo, el hipoclorito de sodio y el peróxido de hidrógeno. El hipoclorito de sodio, una de las principales fuentes de cloro activo utilizado en los blanqueadores clorados, necesita un pH alcalino para estabilizarse. Por su parte, el peróxido de hidrógeno, si no cuenta con algún otro tipo de estabilizador, como la tecnología DeepSense desarrollada por Macler, necesita un pH más ácido para mantenerse estable.
El pH también es importante cuando se trabaja con algunos tipos específicos de tensioactivos, como las aminas óxidas y las betaínas. En condiciones neutras y alcalinas, estos tensioactivos se comportan como si fueran no iónicos. Sin embargo, en condiciones ácidas, estos tensioactivos presentan un comportamiento zwitteriónico, es decir, en condiciones ácidas, sus nitrógenos estarán protonados, generando una carga positiva, lo que hace que actúen como un tensioactivo catiónico. Es imprescindible saber si los componentes de su fórmula tienen esta característica, ya que este cambio en el tipo de tensioactivo puede generar incompatibilidades que conduzcan a la desestabilización e incluso a la separación de fases de la formulación.
Atención a la normativa
Otro punto muy importante que también debe llamar su atención en este contexto es en relación con los aspectos legales. La Agencia Nacional de Vigilancia Sanitaria de Brasil(Anvisa) impone límites en relación con el pH para que su producto sea registrado o simplemente notificado para la venta. En el caso de productos muy ácidos, con un pH de 2 o menos, o muy alcalinos, con un pH de 11,5 o más, se exige el registro del producto, además de la determinación de su potencial corrosivo, para que el producto se clasifique como riesgo 1 o riesgo 2, de acuerdo con la RDC n.º 59, de 17 de diciembre de 2010. Estas situaciones extremas también requieren cuidados especiales con la rotulación y el embalaje, tal y como se establece en la RDC n.º 697, de 13 de mayo de 2022.
Hemos visto en este texto que el pH es un concepto fundamental para trabajar en la industria química y que conocer los matices de sus distintos rangos es algo extremadamente importante, ya sea para el rendimiento, la estabilidad o incluso la situación legal de su producto. Aun así, todavía se puede hablar del pH y sus innumerables efectos derivados en su formulación.
¿Tiene alguna pregunta más específica sobre el pH de su formulación? ¡Póngase en contacto con el equipo del SmartLab para que podamos ayudarle!

Lee también
Cuando la temperatura cambia, pueden surgir turbidez, separación de fases, formación de cristales o alteraciones en la viscosidad. Dos parámetros son especialmente importantes en este análisis: el punto de niebla y el punto de enturbiamiento.
En este artículo, vamos a hablar de las buenas prácticas en cuanto a las formulaciones a base de peróxido y darles consejos para el desarrollo de un producto de alto rendimiento, costo competitivo y alta estabilidad.
Nuestra quimica
Usamos nuestro laboratorio para crear soluciones
químicas inteligentes en equilibrio con su realidad.
Productos
Utilizamos nuestro centro de I+D, un laboratorio interno con profesionales experimentados, para ofrecer soluciones químicas inteligentes en equilibrio con su realidad.
