
Afinal, o que é e para que serve o pH?
Um dos parâmetros mais importantes a se manter sob controle (ou ao menos sob observação) ao trabalhar com produtos químicos é o pH. Então, se você trabalha em uma indústria desta área, certamente já se deparou com estas duas letrinhas em algum momento. Mas, na prática, o que significa esta sigla e como ela pode impactar nos seus produtos?
.jpg)
Definição de pH
Comecemos a desbravar este termo e vejamos para onde este assunto irá nos levar. De forma geral, podemos começar com a definição do que é o pH. Se perguntar isso para um químico, é provável que você receba uma resposta como “pH é o potencial hidrogeniônico de uma solução” ou “pH é uma escala matemática usada para medir a acidez ou basicidade de uma solução”.
Note que nenhuma das definições dadas acima está efetivamente errada. Mas observe que elas também pouco dizem para pessoas que não tem um conhecimento mais aprofundado da química. Afinal, o que seriam estes termos potencial hidrogeniônico, acidez ou basicidade? Dos três termos informados, os dois últimos termos podem parecer um pouco mais fáceis de entender, mas, será que os termos acidez e basicidade isolados dizem alguma coisa real?
De forma direta, estes dois termos não dizem nada muito assertivo, ou seja, vamos considerá-los tão vagos quanto potencial hidrogeniônico. No entanto, podemos partir deles para tentar compreender o que é o pH de uma forma mais assimilável – e para isso, inicialmente, vamos trazer um de nossos sentidos para a mesa, o paladar.
Estes dois termos são facilmente associados a dois tipos de sabores. A acidez pode ser ligada ao sabor azedo, ou seja, alimentos que são ricos no sabor azedo são alimentos ditos ácidos. Por exemplo, o limão e outras frutas cítricas são alimentos que se encaixam nesse grupo de alimentos, sendo um grupo de alimentos ricos em ácido cítrico. Já a basicidade, ou alcalinidade, está diretamente ligada àqueles alimentos que deixam uma sensação de boca seca, áspera ou enrugada, como vinhos secos e frutas que ainda não se encontram devidamente maduras, ou seja, ao sabor adstringente.
Agora que começamos com esta distinção de acidez e basicidade podemos começar a introduzir o conceito de pH: se sabemos que existem estes dois tipos de sabor, não seria possível estabelecermos alguma forma de medir o quão azedo ou quão adstringente um alimento é? Por exemplo, se compararmos o sabor de um limão com o da alface, sabemos que o limão tem sabor bem mais ácido do que a alface, que tem sabor adstringente – mas, quanto mais ácido é este sabor?
Podemos, então, introduzir o pH como uma forma de medir o quão ácido ou o quão básico é um alimento. Logo, se identificarmos algo que seja mensurável para quantificar a acidez, podemos estabelecer uma escala. No entanto, para sabermos o que será medido, não tem como fugirmos de conceitos químicos e físicos.
Voltando no tempo…
No final dos anos 1800, o cientista sueco Svante Arrhenius, um dos fundadores da ciência hoje chamada de físico-química, desenvolveu a teoria da autoionização da água enquanto estudava uma forma de explicar a condutividade de eletrólitos. Em seus estudos, Arrhenius propôs que as moléculas de água no estado líquido não se comportam de forma estática, mas sim num equilíbrio dinâmico, onde elas se quebram e se reconstituem. Em termos químicos, Arrhenius propôs que a molécula da água, HO no estado líquido se comporta da seguinte forma:
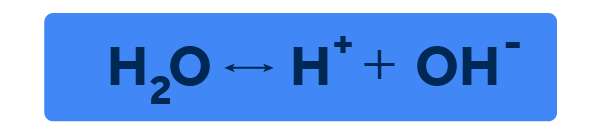
Então, de acordo com a proposta de Arrhenius, as moléculas de água não sofrem apenas interações de suas forças internas, formando e quebrando ligações de hidrogênio, mas também se encontram nesta dança dinâmica, onde a molécula se quebra, gerando íons de carga positiva e negativa, e se reconstitui, retornando ao estado neutro de uma molécula.
Partindo desta teoria, Arrhenius propôs a primeira teoria de ácidos e bases em 1887, onde ele propunha que um ácido seria uma substância que, ao ser solubilizada em água, irá ionizar e produzir um cátion H, chamado hidrogênio, que possui uma carga positiva. Já uma base, seria uma substância que, ao ser solubilizada em água, irá ionizar e produzir um ânion OH, chamado hidroxila, que possui uma carga negativa.
Apesar de simples, esta teoria proposta por Arrhenius era um pouco restritiva. Então, em 1923, os cientistas Johannes Brønsted e Martin Lowry aprimoraram as teorias propostas por Arrhenius, redefinindo ácidos para aquelas substâncias aptas a doarem íons H+ e bases para aquelas substâncias aptas a receberem íons H+. E depois veio a proposição de ácidos e bases feita por Lewys, que tornou o conceito mais abrangente e complexo, definindo os ácidos e bases como compostos com capacidade de doar ou receber pares de elétrons. Essa nova e mais ampla definição feita por Lewys nos permite incluir a amônia, NH, e seus derivados orgânicos (como as aminas) como bases, pois, apesar de não receberem H+ em solução aquosa, como proposto por Johannes Brønsted e Martin Lowry, são substâncias que têm a capacidade de doar par de elétrons.
A escala de pH
Partindo destas definições de ácidos e bases, podemos, então, inferir que um meio ácido será um meio deficitário em elétrons e um meio básico (ou alcalino) será um meio rico em elétrons livres. Ou seja, vimos que podemos avaliar a acidez ou basicidade de um determinado meio a partir de certas características eletrônicas dele – e é aqui que entra a famosa escala do pH.
O pH nada mais será do que uma escala numérica que se construiu à partir de cálculos em cima de medidas de corrente elétrica de soluções aquosas conhecidas. Foi utilizada a corrente elétrica, que é justamente o movimento dos elétrons, pois era ela que dava a condição de indicar a “disponibilidade” dos pares de elétrons livres naquelas soluções. Foi a partir dessas medidas que foi possível identificar a basicidade ou acidez de uma solução. Esta escala foi primeiramente desenvolvida em 1909 na Dinamarca, pelo químico Søren Lauritz Sørensen na cervejaria Carlsberg, tendo sido aprimorada após a divulgação das teorias de Brønsted e Lowry.

De forma geral, é muito comum ouvirmos dizer que a escala do pH varia de 1 até 14, sendo que, quanto mais ácido é um meio, menor será o pH, e quanto mais alcalino, maior será o pH. Apesar do pH na maioria das situações realmente se encontrar entre estes valores, alguns ácidos e bases muito fortes podem fazer com que o pH fique menor do que 1 ou maior do que 14, mas estes são casos muito específicos.
Seguindo a lógica dos valores desta escala de pH apresentados, podemos, inclusive, pensar nela como uma espécie de balança: se valores mais próximos de 1 são ácidos e valores próximos de 14 são básicos, o que podemos dizer da região no meio destes valores, ou seja, do valor de pH igual a 7? Este é o valor de neutralidade de uma solução, ou seja, é um valor da escala em que não podemos dizer que a solução esteja nem ácida e nem básica.

pH e a indústria de produtos de limpeza
Agora que definimos pH, ácidos e bases, o que podemos dizer sobre este assunto no que tange os produtos saneantes? Afinal, pelo que vimos, qualquer mistura contendo água pode apresentar um valor de pH e a água é o veículo mais comum nas indústrias químicas em geral.
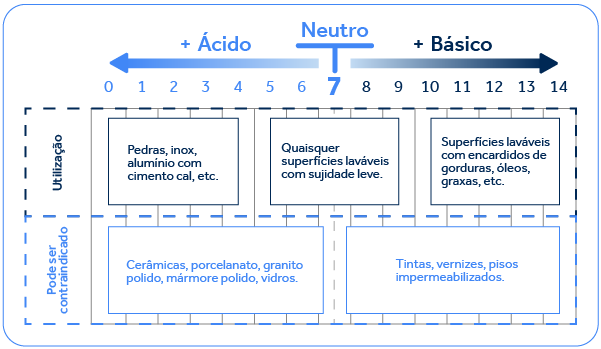
O pH, sobretudo, é uma propriedade fundamental muito importante para diversas classes de produtos saneantes. Tentando trazer para uma compreensão bem simples, o pH ácido reagirá com sujeiras ou superfícies de caráter básico, em geral constituídos por minerais.
Já o pH básico tenderá a reagir com sujidades ou superfícies de caráter ácido, como as gorduras e óleo. Isso faz muita diferença, pois se for utilizado, por exemplo, um pH ácido para limpeza de óleos e gorduras isto irá prejudicar a performance do produto, pois o mesmo não irá reagir com esse tipo de sujidade. Produtos que serão utilizados para uma remoção pesada de óleos e gorduras tendem a se beneficiar de pH mais básico/alcalino, pois essa condição favorece a saponificação de óleos e gorduras, que é justamente a reação do componente alcalino da formulação com a gordura formando sabão. Uma vez que o sabão é solúvel em água, a sujeira passa a ser possível de ser removida por enxágue.
Abaixo podemos ver uma tabela com indicação e exemplos de tipos de superfícies e sujeiras mais ou menos adequadas para cada pH. Este conhecimento é fundamental ao se iniciar o desenvolvimento de um novo produto.
Além deste favorecimento para alguns tipos específicos de limpeza, existem algumas substâncias que precisam de determinadas faixas de pH para serem estabilizadas. Por exemplo, o hipoclorito de sódio e o peróxido de hidrogênio. O hipoclorito de sódio, uma das principais fontes de cloro ativo utilizado em alvejantes clorados, precisa de pH alcalino para se estabilizar. Já o peróxido de hidrogênio, se não contar com alguma outra espécie estabilizante, como a tecnologia DeepSense desenvolvida pela Macler, precisa de um pH mais ácido para se manter estável.
O pH também é importante quando se trabalha com alguns tipos específicos de tensoativos, como as aminas óxidas e betaínas. Em condições neutras e alcalinas, estes tensoativos se comportam como se fossem não iônicos. Mas, em condições ácidas, estes tensoativos apresentam um comportamento zwitteriônico, ou seja, em condições ácidas, seus nitrogênios serão protonados, gerando uma carga positiva, fazendo com que eles atuem como um tensoativo catiônico. Saber se os componentes de sua fórmula têm esta característica é imprescindível, pois essa mudança de tipo de tensoativo pode gerar incompatibilidades que levam à instabilização e até mesmo separação de fases da formulação.
Atenção à regulamentação
Outro ponto muito importante também, que deve chamar a sua atenção neste contexto, é com relação à aspectos legais. A Agência Nacional de Vigilância Sanitária, Anvisa, impõe limites com relação ao pH para que seu produto seja registrado ou apenas notificado para a venda. No caso de produtos muito ácidos, com pH 2 ou menor, ou muito alcalinos, com pH 11,5 ou superior, é exigido o registro do produto, além da determinação de seu potencial corrosivo, para que o produto seja enquadrado como risco 1 ou risco 2, de acordo com a RDC nº 59, de 17 de dezembro de 2010. Estas situações extremas também exigem cuidados especiais com a rotulagem e embalagem, conforme se encontra na RDC nº 697, de 13 de maio de 2022.
Vimos então neste texto que o pH é uma definição fundamental para se trabalhar na indústria química e conhecer as nuances de suas distintas faixas é algo extremamente importante – seja para a performance, estabilidade ou mesmo situação legal de seu produto. E mesmo assim, ainda é possível discorrer sobre o pH e seus inúmeros outros efeitos derivados em sua formulação.
Ficou com alguma dúvida mais específica com relação ao pH de sua formulação? Entre em contato com a equipe do SmartLab para que possamos ajudá-lo!

Leia também
Existem casos em que a espuma é indesejada, passando a ser prejudicial para o processo de limpeza. O objetivo deste artigo é elucidar os caminhos possíveis e viáveis, agilizando o processo de desenvolvimento de um produto com essa característica
Talvez um dos produtos químicos mais conhecidos e utilizados pelo consumidor brasileiro e que influencia drasticamente na cultura e comportamento no que diz respeito à limpeza é o Hipoclorito de Sódio, o famoso “cloro”.
Quando a temperatura muda, podem surgir turbidez, separação de fases, formação de cristais ou alterações na viscosidade. Dois parâmetros são especialmente importantes nessa análise: o ponto de névoa e o ponto de turvação.
Nossa química
Usamos nosso laboratório para criar soluções
químicas inteligentes em equilíbrio com a sua realidade.
Produtos
Usamos nosso centro de P&D, um laboratório próprio com profissionais experientes, para entregar soluções químicas inteligentes em equilíbrio com a sua realidade.
